


Décadas de pesquisa contínua e experiência clínica promoveram uma nova era no tratamento ideal dos distúrbios da mucopolissacaridose (MPS). Esse padrão de tratamento da MPS de rápida evolução depende do geneticista no centro dos cuidados médicos contínuos—um modelo de fornecimento de tratamento que incorpora o tratamento multidisciplinar coordenado e fornece aos médicos oportunidades inigualáveis de mudar as vidas dos pacientes.1-3
A natureza heterogênea e variável de distúrbios da MPS necessita de uma abordagem personalizada para o tratamento coordenado do paciente, começando nos cuidados médicos contínuos. O objetivo do tratamento coordenado é ajudar os pacientes a atingir uma melhor qualidade de vida, o que inclui1:
Para pacientes pediátricos com doença genética multissistêmica crônica, complexa, como a MPS, o tratamento por meio de cuidados médicos contínuos coordenado está associado à redução na utilização de cuidados com a saúde e melhores resultados de saúde.4-7
A coordenação com a equipe de cuidados médicos contínuos deve ser implementada entre todos os elementos do sistema mais amplo de cuidados com a saúde (por exemplo, tratamento especializado, hospitais, tratamento domiciliar e serviços comunitários) e nos planos de tratamento individualizado do paciente.3
Pacientes com MPS possuem alta carga cirúrgica e exigem tratamento anestésico cuidadoso; a função do anestesiologista no tratamento perioperatório é essencial para otimizar os resultados dos pacientes.8,9
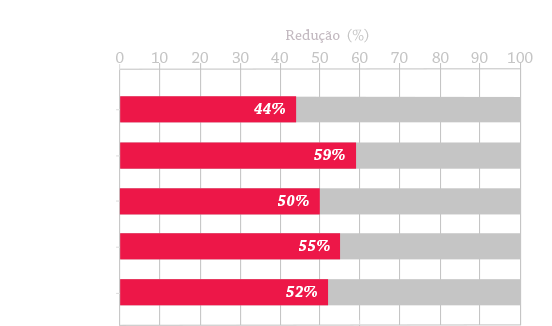
A aplicação do tratamento ideal da MPS, agrupado nos 3 pilares de tratamento a seguir, pode ajudar a melhorar os resultados dos pacientes11:
Paralelamente aos cuidados médicos contínuos, os anestesiologistas exercem um papel significativo na configuração de planos de tratamento individualizado que abrangem o tratamento com procedimento e são essenciais para o monitoramento e a avaliação contínuos de pacientes, para manter a melhora a longo prazo nos resultados clínicos.8,9
A TRE, quando disponível, é o alicerce da terapia.10-12
Um paciente com MPS VI rapidamente progressiva é identificado precocemente, permitindo o rápido início da TRE e melhores resultados clínicos.18

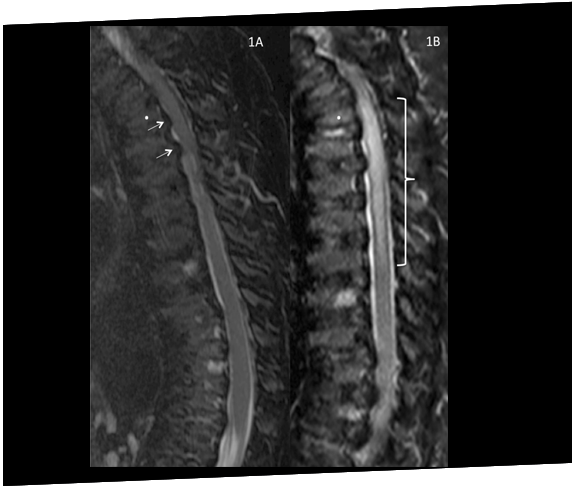
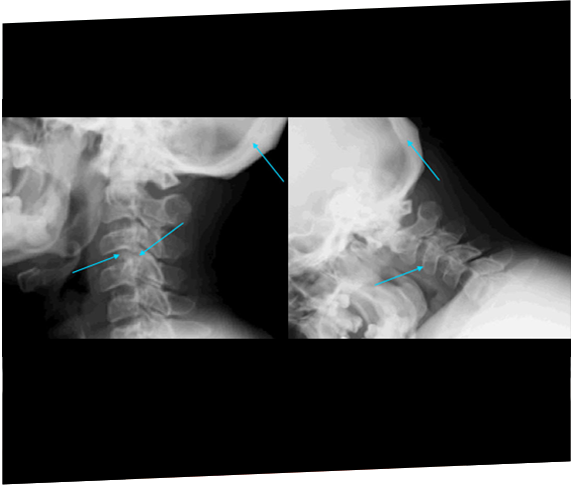
Um paciente com síndrome de Morquio A (MPS IVA) desenvolve compressão da medula espinhal e paraplegia imediatamente após a cirurgia para corrigir joelho valgo, enfatizando a questão da vulnerabilidade à compressão durante a anestesia.19
Uma criança que apresenta retardos no desenvolvimento durante um período de 7 anos foi mais tarde diagnosticada com MPS VI e iniciou a TRE, com melhora clinicamente significativa observada após a TRE.18
Duas irmãs foram, enfim, diagnosticadas com MPS IIIA, após 11 anos de evolução rápida do atraso no desenvolvimento, sendo, então, encaminhados a um geneticista.20
Embora cada subtipo do distúrbio da MPS seja clinicamente diferente, todos contam com manifestações limitantes, progressivas e multissistêmicas da doença comuns para a patologia da MPS.12,14,21,22 O tratamento de pacientes com MPS exige entendimento das manifestações clínicas específicas e das recomendações de tratamento para cada subtipo da MPS.2,11
Novembro de, 2015
Não se atingiu analgesia bilateral ideal do trabalho de parto, apesar de vários ajustes, e analgesia sistêmica foi necessária para a cesariana.
Maio de, 2015
Ocorreram atrasos no diagnóstico devido à ausência ou distância de centros diagnósticos, diagnósticos alternativos e sintomas enganosos apresentados. Vários pacientes
apresentaram manifestações mais sutis do que o esperado e, consequentemente, passaram despercebidas. Os casos também destacaram os desafios únicos associados ao
diagnóstico da MPS VI a partir da perspectiva de diferentes especialidades e fornecem opiniões sobre como esses pacientes a apresentam inicialmente.
Abril de, 2016
Nossa compreensão atual sobre outros problemas cardíacos em adultos com MPSs, principalmente com a circulação coronária e miocárdio, é escassa e é preciso
References: 1. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 2. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 3. Agency for Healthcare Research and Quality. Defining the PCMH. https://pcmh.ahrq.gov/page/defining-pcmh. Accessed December 15, 2015. 4. Casey PH, Lyle RE, Bird TM, et al. Effect of hospital-based comprehensive care clinic on health costs for Medicaid-insured medically complex children. Arch Pediatr Adolesc Med. 2011;165(5):392-398. doi:10.1001/archpediatrics.2011.5. 5. Mosquera RA, Avritscher EBC, Samuels CL, et al. Effect of an enhanced medical home on serious illness and cost of care among high-risk children with chronic illness: a randomized clinical trial. JAMA. 2014;312(24):2640-2648. doi:10.1001/jama.2014.16419. 6. Klitzner TS, Rabbitt LA, Chang RKR. Benefits of care coordination for children with complex disease: a pilot medical home project in a resident teaching clinic. J Pediatr. 2010;156(6):1006-1010. doi:10.1016/j.jpeds.2009.12.012. 7. Gordon JB, Colby HH, Bartelt T, Jablonski D, Krauthoefer ML, Havens P. A tertiary care-primary care partnership model for medically complex and fragile children and youth with special health care needs. Arch Pediatr Adolesc Med. 2007;161(10):937-944. 8. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 9. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 10. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 11. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416. 12. Muenzer J, Beck M, Eng CM, et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. doi:10.1097/GIM.0b013e3181fea459. 13. Kakkis ED, Neufeld EF. The mucopolysaccharidoses. In: Berg BO, ed. Principles of child neurology. New York, NY: McGraw-Hill; 1996:1141-1166. 14. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 15. Lavery C, Hendriksz C. Mortality in patients with Morquio syndrome A. J Inherit Metab Dis Rep. 2015;15:59-66. doi:10.1007/8904_2014_298. 16. Giugliani R, Lampe C, Guffon N, et al. Natural history and galsulfase treatment in mucopolysaccharidosis VI (MPS VI, Maroteaux-Lamy syndrome)—10-year follow-up of patients who previously participated in an MPS VI Survey Study. Am J Med Genet A. 2014;164A(8):1953-1964. doi:10.1002/ajmg.a.36584. 17. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983. 18. Data on file. Biomarin Pharmaceuticals,Inc. 19. Drummond JC, Krane EJ, Tomatsu S, Theroux MC, Lee RR. Paraplegia after epidural-general anesthesia in a Morquio patient with