
A evidência clínica confirmatória resultante de estudos em irmãos sugere que a intervenção precoce proporciona diversas oportunidades de melhorar os resultados dos pacientes por meio do controle específico da doença e do rápido início da TRE, se disponível.1-6
A TRE, de início precoce ou mais tardio, demonstrou melhorar os principais parâmetros clínicos, como medidas de resistência e pulmonares, que são essenciais para a qualidade de vida, a manutenção da deambulação e realização das atividades cotidianas.7,8
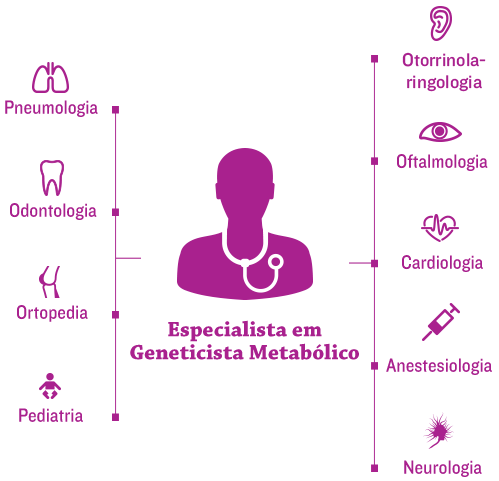
A nova era de tratamento para condições genéticas progressivas e complexas, como as MPS possuem, concentra-se na coordenação eficiente da equipe de tratamento de cada paciente no medical home [cuidados médicos centrados no paciente].1
Geneticistas e/ou especialistas em metabologia costumam estar no centro da equipe médica e ajudam a coordenar o tratamento multidisciplinar e um planejamento de tratamento individualizado.2,3
Distúrbios respiratórios ocorrem em todos os tipos de MPS. Os pneumologistas exercem um papel de destaque na equipe de tratamento multidisciplinar.3,4

Muitas MPS possuem diretrizes disponíveis sobre o tratamento e recomendações consensuais específicas para cada especialidade referente ao tratamento da MPS ao longo da vida. No geral, essas diretrizes recomendam3,6:
Avaliações precoces e contínuas de uma equipe de tratamento coordenado podem melhorar os resultados dos pacientes e ajudar a prevenir danos irreversíveis.6
Muitas manifestações respiratórias da MPS estão relacionadas aos depósitos de glicosaminoglicanos (GAG), que podem causar obstrução das vias aéreas.4 A obstrução das vias aéreas superiores em pacientes com MPS pode oscilar desde graus variáveis de apneia do sono a emergências de ameaça à vida. As estratégias de tratamento da obstrução da via respiratória incluem7:
Visão geral dos tipos de MPS e principais manifestações respiratórias
Distúrbios otorrinolaringológicos e respiratórios da MPS podem ser divididos em anomalias das vias aéreas, alterações na mecânica respiratória e efeitos do sono, conforme demonstrado em um estudo com 21 pacientes portadores de MPS I, II, IV, VI e VII.
Existe uma série de intervenções e considerações para pacientes com MPS com complicações respiratórias em andamento:
O momento da consulta inicial e a frequência de visitas devem ser adaptadas ao tipo de doença e à gravidade dos sintomas. A maioria dos pacientes deve ser atendida após o diagnóstico e, em seguida, a cada 6 a 12 meses.4
A avaliação de rotina da função pulmonar deve incluir4:
Uma vez que pacientes com MPS correm alto risco de complicações decorrentes da sedação anestésica e do procedimento, é importante que um anestesiologista que tenha experiência com pacientes portadores de MPS façam parte da equipe cirúrgica.4 Um especialista respiratório deve estar envolvido tanto antes quanto depois da cirurgia.4,9
Além de avaliações específicas por especialidade que devem ser realizadas para facilitar resultados positivos a longo prazo para pacientes com MPS, medidas importantes podem ser adotadas pelo médico coordenador, geralmente o geneticista e/ou o especialista em metabologia, em relação à saúde geral. Seu papel na educação de outros profissionais da saúde (ex.: dentistas, fisioterapeutas, pediatras, médicos de família) e famílias sobre a doença e as estratégias de tratamento geral é essencial e deve incluir o seguinte:
Avaliações específicas por especialidade, bem como exames físicos de rotina e intervenções de saúde geral, devem seguir as diretrizes recomendadas, que podem variar entre os subtipos de MPS.3
As melhoras no tratamento de distúrbios da MPS contribuem para resultados a longo prazo para pacientes, necessitando de novas abordagens para o tratamento vitalício.
À medida que os pacientes envelhecem, alguns podem começar a administrar seu tratamento, tornando crucial a orientação médica na transição para o contexto adulto.3 Os médicos devem assegurar:
A transição do tratamento pediátrico para o adulto e o tratamento adulto a longo prazo são áreas críticas a serem consideradas no planejamento do tratamento para pacientes adolescentes e adultos.3 As considerações do tratamento de longa duração são melhor abordadas em uma clínica com experiência considerável em MPS e requerem coordenação cuidadosa entre as diferentes especialidades.3,11 As questões a longo prazo incluem, mas não se limitam a:
O tratamento a longo prazo de distúrbios da MPS—incluindo avaliações contínuas e estratégia de transição do tratamento pediátrico para adulto específica do centro— pode levar à melhoria sustentada da qualidade de vida e a um futuro melhor para seus pacientes.3,11-13
Uma vez que as manifestações clínicas dos distúrbios da mucopolissacaridose (MPS) são multissistêmicas, é necessária uma abordagem multidisciplinar específica ao paciente para reconhecer e tratar as complicações de maneira proativa. Os pneumologistas desempenham um papel importante no planejamento pré- e pós-operatório.1
Os pacientes com distúrbios da MPS costumam passar por uma série de intervenções cirúrgicas ao longo da vida. Um estudo do curso natural, que avaliou uma coorte de 325 pacientes com Morquio A (MPS IVA), constatou que mais de 70% deles tinham sido submetidos a pelo menos um procedimento cirúrgico.2

Os pacientes com MPS apresentam alta taxa de mortalidade perioperatória devido a múltiplos fatores, incluindo obstrução das vias aéreas superiores e inferiores, instabilidade da coluna cervical, comprometimento respiratório, morbidades cardiovasculares e infecções frequentes.2-4 Por exemplo, complicações cirúrgicas resultaram em uma taxa de mortalidade de 11% em pacientes com Morquio A (n=27).5
Criar um planejamento cirúrgico é essencial e envolve uma equipe multidisciplinar de especialistas que, idealmente, possuem experiência no tratamento de pacientes com MPS.3
A preparação para o risco cirúrgico e anestésico em pacientes com MPS requer uma equipe de tratamento multidisciplinar e com experiência, composta por anestesiologista, cardiologista, pneumologista e otorrinolaringologista.3
Os fatores de risco anestésicos incluem os itens a seguir, destacados na figura abaixo.
A avaliação do risco cirúrgico e o monitoramento perioperatório são componentes fundamentais de um planejamento cirúrgico personalizado e podem reduzir os riscos de resultados cirúrgicos negativos e mortalidade em pacientes com MPS.3,9,10
Considerações pré- e pós-operatórias adicionais específicas à pneumologia devem ser levadas em conta1:
Pré-operatório
Pós-operatório
Antes de qualquer sedação ou anestesia, os pneumologistas devem aconselhar os pacientes e as famílias, incluindo discussão sobre o risco de traqueostomia de emergência.1
References: 1. McGill JJ, Inwood AC, Coman DJ, et al. Enzyme replacement therapy for mucopolysaccharidosis VI from 8 weeks of age—a sibling control study. Clin Genet. 2010;77(5):492-498. doi:10.1111/j.1399-0004.2009.01324.x. 2. Furujo M, Kubo T, Kosuga M, Okuyama T. Enzyme replacement therapy attenuates disease progression in two Japanese siblings with mucopolysaccharidosis type VI. Mol Genet Metab. 2011;104(4):597-602. doi:10.1016/j.ymgme.2011.08.029. 3.Clarke LA. Pathogenesis of skeletal and connective tissue involvement in the mucopolysaccharidoses: glycosaminoglycan storage is merely the instigator. Rheumatology (Oxford). 2011;50(suppl 5):v13-18. 4. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 5. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 6. Muenzer J, Beck M, Eng CM, et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. doi:10.1097/GIM.0b013e3181fea459. 7. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 8. Muenzer J. Early initiation of enzyme replacement therapy for the mucopolysaccharidoses. Mol Genet Metab. 2014;111(2):63-72. doi:10.1016/j.ymgme.2013.11.015. 9. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 10. Bagewadi S, Roberts J, Mercer J, Jones S, Stephenson J, Wraith JE. Home treatment with Elaprase® and Naglazyme® is safe in patients with mucopolysaccharidoses types II and VI, respectively. J Inherit Metab Dis. 2008;31(6):733-737. doi:10.1007/s10545-008-0980-0. 11. BioMarin Pharmaceutical Inc. VIMIZIM Web site. http://www.vimizim.com/. Accessed December 21, 2015. 12. BioMarin Pharmaceutical Inc. Naglazyme Web site. http://www.naglazyme.com/. Accessed December 21, 2015. 13. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416.
References: 1. Agency for Healthcare Research and Quality. Defining the PCMH. https://pcmh.ahrq.gov/page/defining-pcmh. Accessed December 15, 2015. 2. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 3. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 4. Muhlebach MS, Wooten W, Muenzer J. Respiratory manifestations in mucopolysaccharidoses. Paediatr Respir Rev. 2011;12(2):133-138. doi:10.1016/j.prrv.2010.10.005. 5. Berger KI, Fagondes SC, Giugliani R, et al. Respiratory and sleep disorders in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):201-210. doi:10.1007/s10545-012-9555-1. 6. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416. 7. Wold SM, Derkay CS, Darrow DH, Proud V. Role of the pediatric otolaryngologist in diagnosis and management of children with mucopolysaccharidoses. Int J Pediatr Otorhinolaryngol. 2010;74(1):27-31. doi:10.1016/j.ijporl.2009.09.042. 8. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 9. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 10. James A, Hendriksz CJ, Addison O. The oral health needs of children, adolescents and young adults affected by a mucopolysaccharide disorder. JIMD Rep. 2012;2:51-58. doi:10.1007/8904_2011_46. 11. Coutinho MF, Lacerda L, Alves S. Glycosaminoglycan storage disorders: a review. Biochem Res Int. 2012;2012:471325. doi:10.1155/2012/471325. 12. Kakkis ED, Neufeld EF. The mucopolysaccharidoses. In: Berg BO, ed. Principles of child neurology. New York, NY: McGraw-Hill; 1996:1141-1166. 13. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48.
References: 1. Muhlebach MS, Wooten W, Muenzer J. Respiratory manifestations in mucopolysaccharidoses. Paediatr Respir Rev. 2011;12(2):133-138. doi:10.1016/j.prrv.2010.10.005. 2. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 3. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 4. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 5. Lavery C, Hendriksz C. Mortality in patients with Morquio syndrome A. J Inherit Metab Dis Rep. 2015;15:59-66. doi:10.1007/8904_2014_298. 6. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x. 7. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 8. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 9. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 10. Vitale MG, Skaggs DL, Pace GI, et al. Delphi Consensus Report: Best practices in intraoperative neuromonitoring in spine deformity surgery: development of an intraoperative checklist to optimize response. Spine Deformity. 2014;2(5):333-339. doi:10.1016/j.jspd.2014.05.003. 11. Solanki GA, Alden TD, Burton BK, et al. A multinational, multidisciplinary consensus for the diagnosis and management of spinal cord compression among patients with mucopolysaccharidosis VI. Mol Genet Metab. 2012;107:15-24. doi:10.1016/j.ymgme.2012.07.018. 12. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983.